Os modelos atômicos são fundamentais para compreendermos a estrutura da matéria.
Eles evoluíram ao longo do tempo, trazendo novas descobertas sobre como os átomos se organizam e interagem.
Neste post, vamos explorar as diferentes teorias e modelos que explicam a composição da matéria, desde os primórdios da química até as mais recentes descobertas na física quântica.
O que são Modelos Atômicos?
Os modelos atômicos são representações teóricas que nos ajudam a compreender a estrutura da matéria em nível atômico. Eles descrevem como os átomos são organizados, como interagem entre si e quais são suas propriedades. Através da evolução do conhecimento científico, diferentes modelos foram propostos para explicar a composição e o comportamento dos átomos.
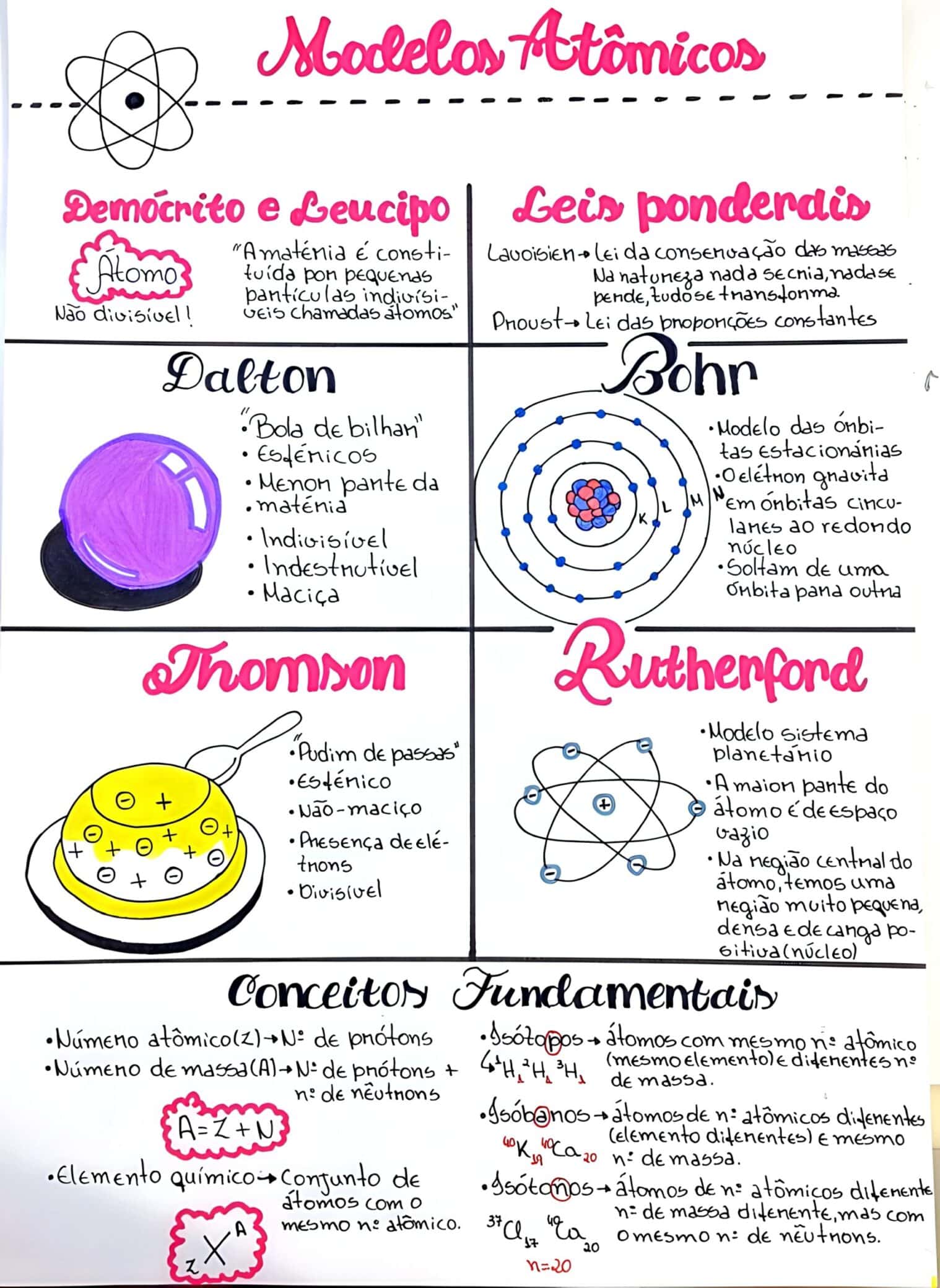
O modelo atômico de John Dalton, proposto no início do século XIX, afirmava que os átomos eram esferas sólidas e indivisíveis. A partir de suas ideias, podemos observar que:
| Características do Modelo de Dalton | Descrição |
|---|---|
| Indivisibilidade | Os átomos são a menor unidade da matéria. |
| Identidade | Átomos de um mesmo elemento são idênticos. |
| Combinações | Átomos se combinam em proporções fixas para formar compostos. |
Com o avanço da ciência, o modelo de J.J. Thomson trouxe a ideia do átomo como uma esfera carregada positivamente, na qual elétrons estão incrustados, semelhante a um pudim. Essa ideia foi revolucionária e ressaltou a presença de partículas subatômicas:
“Os átomos não são indivisíveis, mas compostos de partes menores que têm cargas opostas.” – J.J. Thomson, 1897.
Em seguida, o modelo de Ernest Rutherford sugeriu que os átomos possuem um núcleo central pequeno e denso, com partículas carregadas positivamente (prótons) e que os elétrons orbitam ao redor desse núcleo. A representação desse modelo pode ser expressa por:
\( \text{Estrutura do Modelo de Rutherford:} \newline \text{Núcleo } (p^+) \text{ com Elétrons } (e^-) \text{ orbitando.} \)Por último, o modelo de Niels Bohr complementou a visão de Rutherford ao sugerir que os elétrons orbitam em níveis de energia fixos, sem perder energia:
\( E_n = -\frac{k \times e^2}{n^2} \)Onde E representa a energia do nível, k é uma constante e n é o número do nível quântico.
Nos tempos modernos, o modelo quântico da matéria descreve elétrons como ondas e partículas, utilizando a mecânica quântica. Esse modelo oferece uma compreensão mais completa da distribuição de elétrons e suas energias:
“A mecânica quântica nos ensina que não podemos conhecer a posição e a velocidade de uma partícula ao mesmo tempo.” – Werner Heisenberg.
Assim, a evolução dos modelos atômicos não só melhorou nosso entendimento sobre a estrutura da matéria, mas também possibilitou inúmeras aplicações práticas na química, física e biologia, levando a avanços em tecnologias e medicamentos. Através das constantes descobertas científicas, continuamos a desvendar os mistérios do microcosmo atômico.
A História dos Modelos Atômicos
A História dos Modelos Atômicos
Desde a Antiguidade, a busca pela compreensão da estrutura da matéria tem sido uma constante na história da ciência. Os filósofos gregos, como Demócrito, foram alguns dos primeiros a propor a ideia de que a matéria é composta por partículas indivisíveis, que ele chamou de átomos.
Com o passar dos séculos, essa ideia evoluiu e novos modelos foram criados para explicar a natureza atômica. Em 1803, John Dalton apresentou sua teoria atômica, que estabelecia que todos os átomos de um elemento são idênticos e que eles se combinam em proporções inteiras para formar compostos. Esta ideia fundamental foi um passo crucial para a compreensão das reações químicas.
Nos anos seguintes, J.J. Thomson descobriu o elétron através de experimentos com tubos de raio catódico, levando à proposta do modelo chamado de pudim de passas, onde os elétrons estavam dispersos em uma ‘sopa’ de carga positiva. Este conceito revolucionou a visão das partículas subatômicas.
Em 1911, Ernest Rutherford realizou seu famoso experimento com a folha de ouro, que mostrou que a maioria da massa do átomo está concentrada em um núcleo pequeno e denso, e que a maioria do volume do átomo é espaço vazio. Assim, o modelo nuclear surgiu, alterando completamente a perspectiva sobre a estrutura atômica.
Com esses avanços, surgiram debates sobre a configuração dos elétrons em torno do núcleo. O modelo de Niels Bohr introduziu a ideia de que os elétrons se movem em órbitas quantizadas, o que explicava a emissão e absorção de luz pelos átomos.
O entendimento da quantização da energia levou a uma nova era, onde o modelo quântico da matéria, desenvolvido por cientistas como Werner Heisenberg e Erwin Schrödinger, proporcionou uma descrição probabilística da localização dos elétrons. Os conceitos de número quântico e dualidade onda-partícula foram introduzidos para explicar comportamentos complexos dos átomos.
| Modelo Atômico | Principais Características |
|---|---|
| Modelo de Dalton | Átomos são indivisíveis e indestrutíveis, combinando-se em razões simples. |
| Modelo de Thomson | Átomos são compostos de uma ‘sopa’ positiva com elétrons dispersos. |
| Modelo de Rutherford | O núcleo é pequeno, denso e positivamente carregado, enquanto os elétrons orbitam ao redor. |
| Modelo de Bohr | Os elétrons se movem em órbitas quantizadas com níveis específicos de energia. |
| Modelo Quântico | Descrição probabilística dos elétrons com base na mecânica quântica. |
Como disse o físico Albert Einstein, “A mente que se abre a uma nova ideia jamais voltará ao seu tamanho original”. Essa citação encapsula a evolução constante do conhecimento na área da química e da física, permitindo que os alunos de cursinhos pré-vestibulares compreendam a importância dos modelos atômicos na formação da matéria e das bases da ciência moderna.
Principais Modelos Atômicos: Dalton, Thomson e Rutherford
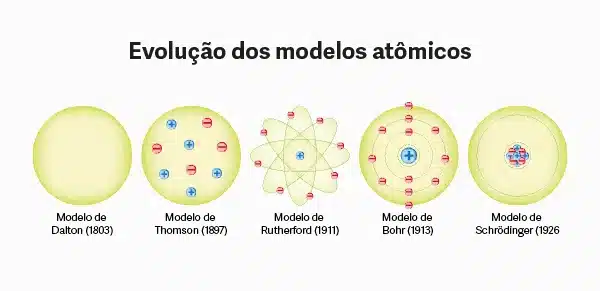
Os modelos atômicos são representações que tentam explicar a estrutura e o comportamento da matéria. Cada modelo reflete o conhecimento da época em que foi proposto, assim como as descobertas científicas. Vamos explorar os três principais modelos atômicos que moldaram a nossa compreensão atual: Dalton, Thomson e Rutherford.
O Modelo Atômico de Dalton (1803):
John Dalton foi um dos primeiros cientistas a propor uma teoria sobre a composição da matéria. Ele sugeriu que a matéria é composta por átomos, partículas indivisíveis e indestrutíveis. Dalton acreditava que os átomos de diferentes elementos possuem massas diferentes e se combinam em proporções fixas para formar compostos.
Alguns aspectos importantes do modelo de Dalton incluem:
- Os átomos são esferas sólidas;
- Átomos de um mesmo elemento são idênticos em massa e propriedades;
- Reações químicas envolvem a combinação, separação ou reorganização de átomos.
Essa visão foi um avanço significativo para a química, estabelecendo a base para a lei das combinações constantes.
O Modelo Atômico de Thomson (1897):
Após a descoberta do elétron por J.J. Thomson, um novo modelo foi formulado. Thomson propôs o modelo “pudim de passas”, sugerindo que os átomos são compostos por uma massa positiva onde os elétrons são distribuídos como passas em um pudim.
Isso levou à compreensão que o átomo não é uma esfera sólida e indivisível. Em sua obra, Thomson disse: “Se os elétrons são considerados como ‘passas’, então a massa positiva do átomo é o ‘pudim’ que os mantém unidos”. Essa concepção desafiou o conceito anterior de Dalton.
O Modelo Atômico de Rutherford (1911):
Ernest Rutherford, através de seus experimentos de dispersão de partículas alfa, chegou à conclusão de que o átomo possui um núcleo central que concentra a maior parte de sua massa e carga positiva. Ele descreveu o átomo como um sistema solar atômico, onde os elétrons giram ao redor do núcleo, similar aos planetas ao redor do sol:
| Modelo | Proponentes | Características |
|---|---|---|
| Dalton | John Dalton | Átomos indivisíveis, massa constante |
| Thomson | J.J. Thomson | Modelo “pudim de passas”, elétrons negativos |
| Rutherford | Ernest Rutherford | Núcleo positivo, elétrons orbitais |
Rutherford ilustrou isso afirmando: “É como se o átomo fosse uma grande esfera vazia com um pequeno núcleo no centro, onde a massa é concentrada”. O modelo de Rutherford foi fundamental para o desenvolvimento da teoria nuclear da matéria e abriu caminho para novas descobertas no campo da física.
Esses modelos atômicos demonstram a evolução do entendimento científico sobre a estrutura da matéria, cada um contribuindo significativamente para o conhecimento atual.
O Modelo Atômico de Bohr
O Modelo Atômico de Bohr, proposto pelo físico dinamarquês Niels Bohr em 1913, representa um avanço crucial na compreensão da estrutura atômica. Este modelo foi desenvolvido para explicar a estabilidade dos átomos e a emissão de espectros de linha observada em elementos químicos.
De acordo com Bohr, os elétrons orbitam o núcleo atômico em trajetórias circulares. Cada órbita corresponde a uma camada de energia específica e, quando um elétron se move entre essas camadas, a troca de energia ocorre através da emissão ou absorção de luz. Essa interação pode ser ilustrada pela fórmula:
\(E = hf\)onde E é a energia, h é a constante de Planck e f é a frequência da radiação emitida ou absorvida.
Logo, para um elétron em uma determinada órbita, a energia é quantizada e expressa pela equação:
\(E_n = -\frac{Z^2 e^4 m}{2 \times \text{h}^2 n^2}\)onde:
- Z: número atômico do elemento
- e: carga do elétron
- m: massa do elétron
- n: número quântico principal
A figura abaixo ilustra a configuração das órbitas eletrônicas no modelo de Bohr:
| Camada | Número Quântico (n) | Energia (E) |
|---|---|---|
| K | 1 | E_1 = -13.6 \, eV |
| L | 2 | E_2 = -3.4 \, eV |
| M | 3 | E_3 = -1.51 \, eV |
Bohr foi influenciado pelo trabalho de outros cientistas, como Erwin Schrödinger e Louis de Broglie. Na avaliação de Schrödinger, “A mecânica quântica se estabeleceu como uma ferramenta essencial na física moderna” (Schrödinger, 1926).
Assim, o Modelo Atômico de Bohr não apenas fornece uma base para o entendimento da estrutura atômica, mas também abriu caminho para a mecânica quântica e novas abordagens na física e na química.
Modelo Quântico da Matéria
O Modelo Quântico da Matéria é uma das mais importantes inovações na compreensão da estrutura atômica. Ele se baseia na teoria quântica, que descreve como as partículas subatômicas, como elétrons, se comportam. Ao contrário dos modelos anteriores, que consideravam os elétrons como partículas em órbitas definidas, o modelo quântico propõe que os elétrons existem em nuvens de probabilidade onde é mais provável encontrá-los.
Uma das grandes conquistas desta teoria é a introdução do conceito de orbital atômico, que é uma região no espaço onde há uma alta probabilidade de encontrar um elétron. Os orbitais são descritos por funções de onda, que são obtidas a partir da Equação de Schrödinger, expressa pelo shortcode:
\( -\frac{\text{ħ}^2}{2m}\nabla^2 \text{Ψ} + V \text{Ψ} = E \text{Ψ} \)A superposição dos estados é outra característica essencial do modelo quântico, onde um elétron pode estar em múltiplos estados ao mesmo tempo, até ser medido. Essa propriedade foi evidenciada em experimentos como o famoso experimento da dupla fenda, que demonstrou que a luz pode se comportar tanto como partícula quanto como onda.
Além disso, é importante entender o princípio de indeterminação de Heisenberg, que afirma que não é possível conhecer simultaneamente a posição e o momento de uma partícula com precisão absoluta. Essa incerteza é uma característica fundamental do comportamento quântico:
\( \text{Δx} \text{Δp} \text{≥} \frac{\text{ħ}}{2} \)| Princípio | Descrição |
|---|---|
| Princípio da Superposição | Partículas podem existir em múltiplos estados. |
| Princípio de Incerteza | Não podemos conhecer posição e momento simultaneamente. |
“A física quântica mostra um novo mundo em que as partículas não estão em um estado determinístico, mas em um estado de probabilidade.” – Albert Einstein
As aplicações práticas do modelo quântico são vastas e incluem tecnologias como transistores, lasers e computação quântica. Compreender o modelo quântico é essencial para qualquer estudante de química e física que deseja se aprofundar no estudo da estrutura da matéria.
Aplicações Práticas dos Modelos Atômicos
Os modelos atômicos são fundamentais para entendermos a estrutura da matéria e suas interações. Sua aplicação prática pode ser observada em diversas áreas, como a medicina, a química e a tecnologia.
Uma das aplicações mais célebres é a utilização da radioterapia no tratamento do câncer. Este método utiliza a radiação para destruir células cancerígenas, explorando os princípios do modelo quântico que rege o comportamento das partículas subatômicas.
| Técnica | Área de Aplicação | Descrição |
|---|---|---|
| Radioterapia | Medicina | Uso de radiação para tratar câncer. |
| Imagem por Ressonância Magnética (IRM) | Diagnóstico Médico | Técnica que explora o comportamento dos átomos em campos magnéticos. |
| Drogas Quimioterápicas | Medicina | Interferem na divisão celular, visando células cancerígenas. |
Além disso, os modelos atômicos são aplicados na indústria química, permitindo a síntese de novos compostos e o desenvolvimento de materiais com propriedades específicas. O modelo atômico de Bohr, por exemplo, é utilizado para entender a estrutura eletrônica dos átomos, o que é essencial para reações químicas.
Como disse Albert Einstein: “A ciência não pode ficar parada, deve sempre se mover em direção ao que se conhece de forma mais verdadeira e mais ampla.” Esta citação ilustra a importância de entender os modelos atômicos para avançarmos como sociedade.
Os conceitos por trás dos modelos atômicos também influenciam a tecnologia, como no desenvolvimento de células solares, onde a interação da luz com elétrons é fundamental. Através do entendimento da estrutura atômica, as pesquisas têm avançado significativamente para a criação de dispositivos mais eficientes e sustentáveis.
Finalmente, a descoberta e a aplicação prática de novos modelos atômicos nos permitem não apenas explicar fenômenos naturais, mas também inovar e criar soluções para desafios globalmente.
Resumeira













